在众多癌症中,胰腺癌有着“癌王”的称号,具有发病率高、复发率高、死亡率高、侵袭性极强的特点。胰腺导管腺癌(PDAC)是最常见、最致命的胰腺癌类型,由于缺乏早期症状,大多数患者直到晚期才被诊断出来。因此临床需要可重复、准确的生物标志物进行高风险和临床适应症人群的早期PDAC诊断。
临床常用的PDAC血液CA19-9检测在敏感性和阳性预测值(PPV)方面仍存在不足。超声内镜引导下细针穿刺活检(EUS-FNA)是目前标准临床实践中最敏感的PDAC诊断方法,但该方法具有侵入性、价格昂贵,需要高度熟练的操作人员,且仅限于主要医疗机构使用。此外,在许多情况下,EUS-FNA可能无法提供明确的诊断。为此,研究人员将目光投向了日益成熟的液体活检技术。
已有研究表明,cfDNA和cfRNA都可以区分疾病状态。近期,王红阳等团队利用NGS从胰腺癌患者中获取血浆cfDNA片段化、末端基序、核小体足迹(NF)和拷贝数改变(CNA)特征,建立了胰腺癌的早期检测模型(PCM评分)和预后模型(PCP评分),该模型在区分早期胰腺癌患者和非癌症对照者方面表现优异。那么除cfDNA外,血浆中的cfRNA是否也能用于胰腺癌检测,识别PDAC与复杂的中间病理状态呢?
近日,美国Knight癌症研究所团队在Nature Communications发表文章“Cell free RNA detection of pancreatic cancer in pre diagnostic high risk and symptomatic patients”,报道了无创检测早期PDAC的最新研究成果。研究团队提出了一种无创评估血浆cfRNA的方法,用于建议进行EUS-FNA的高风险和有临床适应症患者的PDAC检测。利用术前样本,研究团队获得了29个潜在的cfRNA生物标志物。这些生物标志物还被用于训练机器学习分类器,以预测PDAC与胰腺良性病变、其它中间病变。分析显示,该分类器在高危患者的独立验证队列中保持了高性能。以上结果表明,cfRNA检测或能成为预测和监测PDAC的一种无创替代方法。

主要研究内容
研究团队对有临床适应症的患者进行了EUS筛查前抽取血样,分为发现队列(153个样本)和验证队列(95个样本)。为解释分析前的变异和处理效应,研究人员开发了一种cfRNA标准化方法,并在发现队列的153个样本中获得29个候选cfRNA生物标志物用于PDAC诊断。
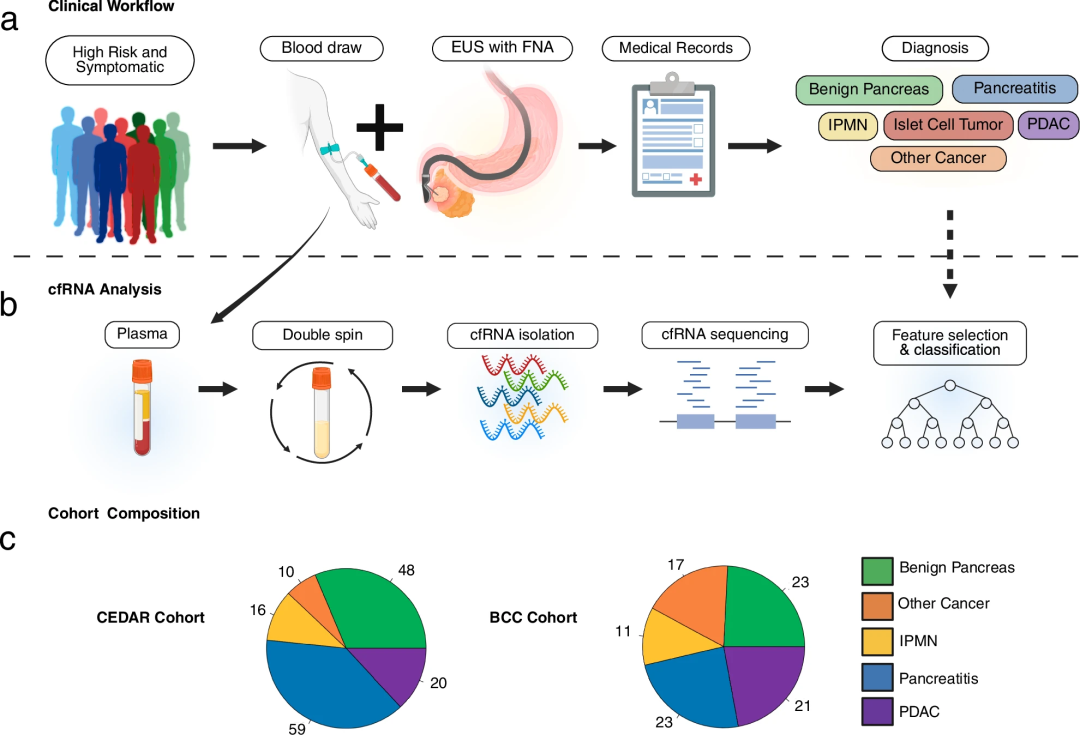
图1.研究设计
通过比较人类蛋白图谱中不同组织类型的相对表达,研究发现以上cfRNA生物标志物在肝脏、淋巴结、胰腺和其他免疫相关组织(如骨髓、扁桃体和脾脏)中高度表达(图2)。在发现队列数据集中,PDAC患者最常见的转移部位是肝脏和淋巴结。肝脏的表达虽然总体上也是最高的,但它含有独特的差异表达基因组合,在其他高表达的组织中没有富集,特别是SERPINA1、ACOT12、CRP和AFMID。同时,这四个基因在发现队列和验证队列的PDAC样本中都上调。与之相反,免疫相关基因(RPS4X、RPS13、RPS14、CD37、MS4A1、TNFRSF13C、PAX5、FAM117A)在两个数据集的PDAC样本中均下调,证实了PDAC具有非常低水平的浸润免疫细胞。
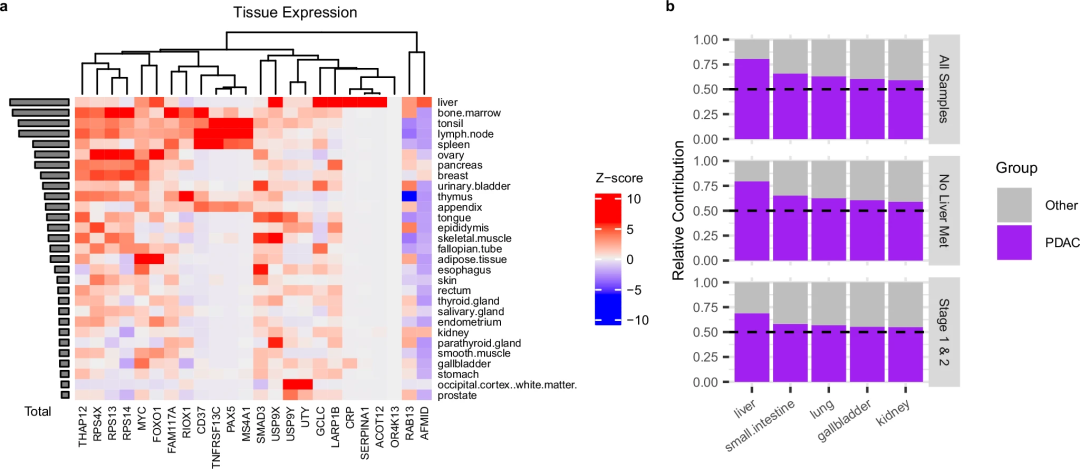
图2.对PDAC cfRNA生物标志物水平的反褶积。
利用29个cfRNA候选生物标志物,研究团队训练了一个机器学习模型来对PDAC诊断的患者进行分类,主要识别“PDAC”和“非PDAC”。研究设置了三个实验:PDAC和良性诊断的样本,胰腺炎和IPMN(胰腺导管内乳头状粘液性肿瘤)样本,所有可用的样本。结果显示,在每种情况下,该分类器都能准确区分PDAC样本与所有其他样本,即使包括中间胰腺病理状态和其他癌症类型。PDAC与胰腺良性病变、其他中间病变以及所有其他诊断的鉴别AUC分别为0.945、0.965和0.956,年龄和性别无明显差异。以上结果揭示了cfRNA生物标志物在PDAC诊断中的预测潜力。
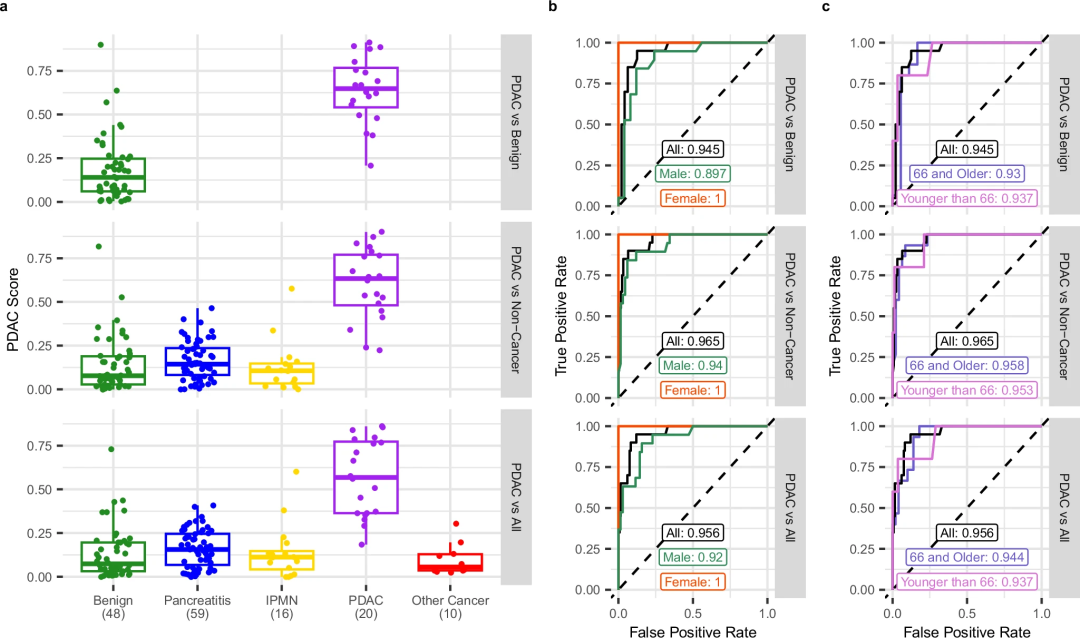
图3.PDAC cfRNA分类器在发现队列中交叉验证。
随后,研究团队在独立队列中验证了cfRNA生物标志物的性能,使用训练的PDAC分类器评估了PDAC与良性病变、PDAC与非癌症样本以及PDAC与所有其他诊断的三种模型设置。研究发现,独立验证队列的所有3种模型设置中,PDAC样本与其他诊断强烈分离(图4)。cfRNA分类器在区分PDAC与良性病变、胰腺其他中间病理状态和所有其他诊断时,AUC分别为0.904、0.937和0.896(图4b,c)。以上结果表明了29个cfRNA生物标志物在患者转诊到EUS-FNA程序前检测PDAC的诊断潜力。
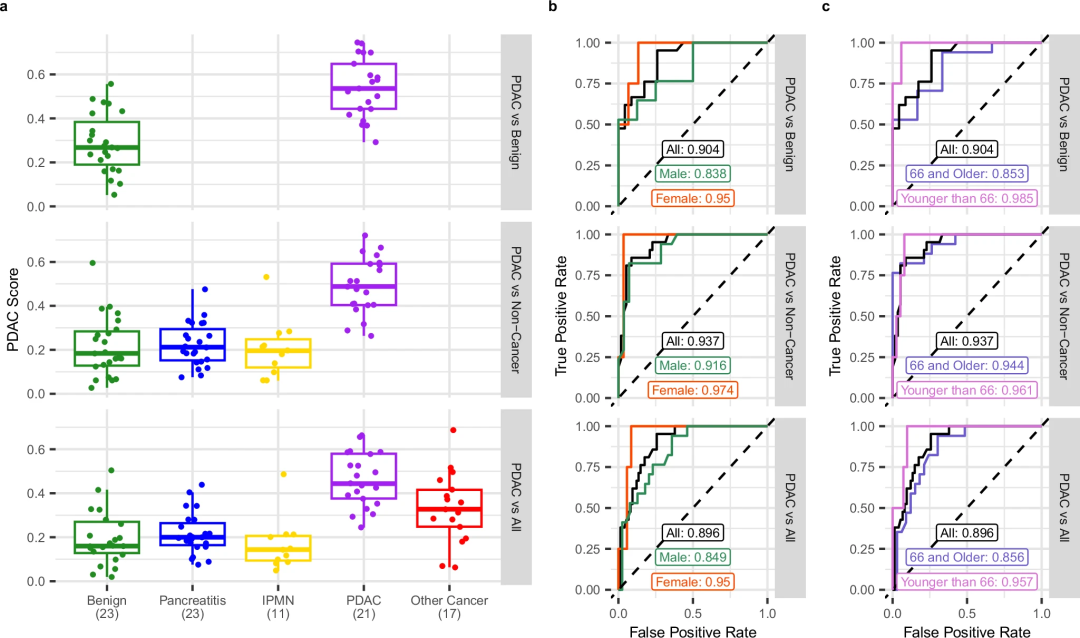
图4.PDAC cfRNA分类器在独立队列中的验证。
此外,研究团队比较了cfRNA PDAC分类器与CA19-9检测的准确性,发现cfRNA分类器在交叉验证和独立验证中均优于CA19-9检测(图5)。
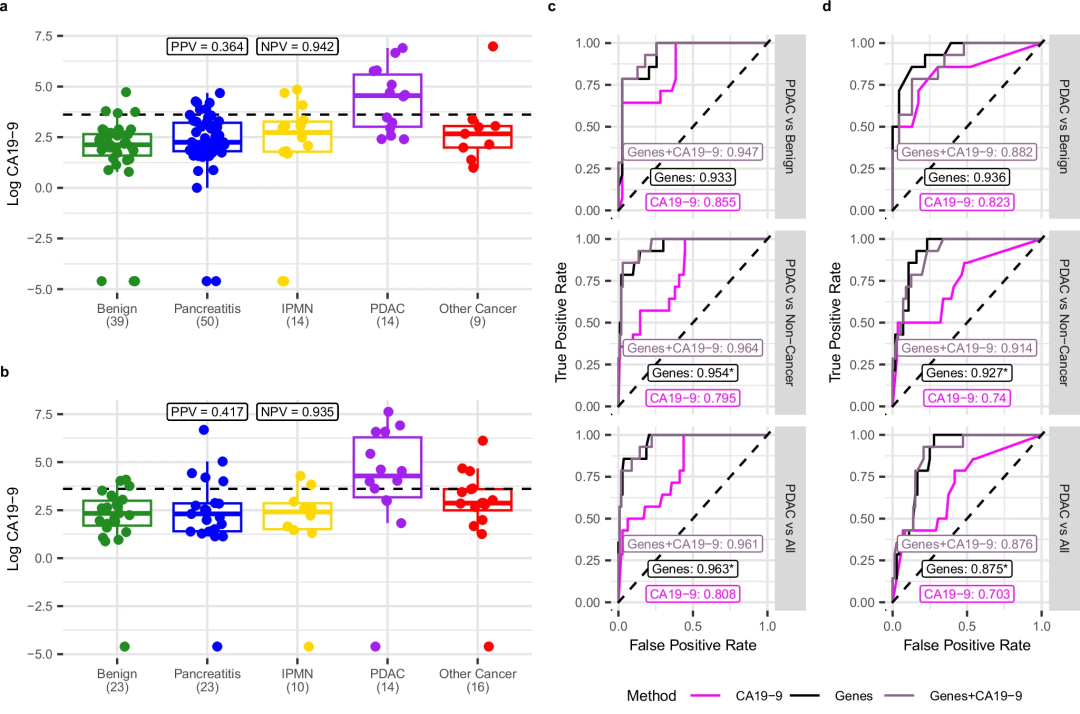
图5.cfRNA分类器与CA19-9测定的比较。
结 语
在临床环境中,血液生物标志物用于筛查和确诊胰腺疾病的高风险和新发症状患者的有效性尚未得到充分发展。该研究新发现的cfRNA生物标志物可以将PDAC与胰腺的中间病理状态区分开来,包括所有不同的诊断,如胰腺的良性状况、慢性和急性胰腺炎、IPMN和其他癌症类型。与CA19-9相比,这些cfRNA生物标志物显著改进了临床诊断PDAC的效用。
此外,已有的基于血液检测PDAC的研究多是采用病例对照设计,在确诊患者中采集样本。该研究采用的诊断前抽样方法确保了高风险患者群体的代表性,可帮助这些患者从诊断前筛查检测中获益,并确定是否进行侵入性EUS-FNA检查。
原文信息:
Moore, T.W., Spiliotopoulos, E., Callahan, R.L. et al. Cell free RNA detection of pancreatic cancer in pre diagnostic high risk and symptomatic patients. Nat Commun 16, 7345 (2025).
https://doi.org/10.1038/s41467-025-62685-y
内容中包含的图片若涉及版权问题,请及时与我们联系删除

