宾夕法尼亚大学的研究人员发现,红细胞(不仅仅是血小板)在血凝块收缩中发挥着积极作用。多年来,科学家们一直认为,红细胞只是在血凝块形成过程中充当辅助角色,并没有发挥太大作用。宾夕法尼亚大学的一项新研究表明,红细胞在帮助血凝块收紧和收缩方面发挥着积极作用。
“这一发现重塑了我们对人体最重要过程之一的理解,”佩雷尔曼医学院 (PSOM) 高级研究员、该研究的合著者 Rustem Litvinov 表示。“它也为研究和潜在治疗导致过度出血或危险血栓(例如中风)的凝血障碍开辟了新的策略。”
这项研究最近发表在《血液进展》杂志上,挑战了长期以来的观点,即只有血小板(负责封闭伤口的微小碎片)才能导致血凝块收缩。宾夕法尼亚大学的研究团队证明,红细胞本身在血凝块收缩过程中起着直接的强化和稳定作用。
“红细胞自17世纪以来就已被研究,”论文合著者、宾夕法尼亚大学工程学院机械工程与应用力学教授Prashant Purohit说道。“令人惊讶的是,在21世纪,我们仍在不断发现关于红细胞的新知识。”
此前,研究人员认为只有血小板才能导致血凝块收缩。这些微小的细胞碎片拉动绳状纤维蛋白,从而收紧并稳定血凝块。
“红细胞曾被认为是被动的旁观者,”论文共同作者、宾夕法尼亚大学医学院细胞与发育生物学教授、宾夕法尼亚大学工程学院生物工程研究生组成员约翰·韦塞尔(John Weisel)说。“我们以为它们只是在帮助血凝块形成更好的封闭。”
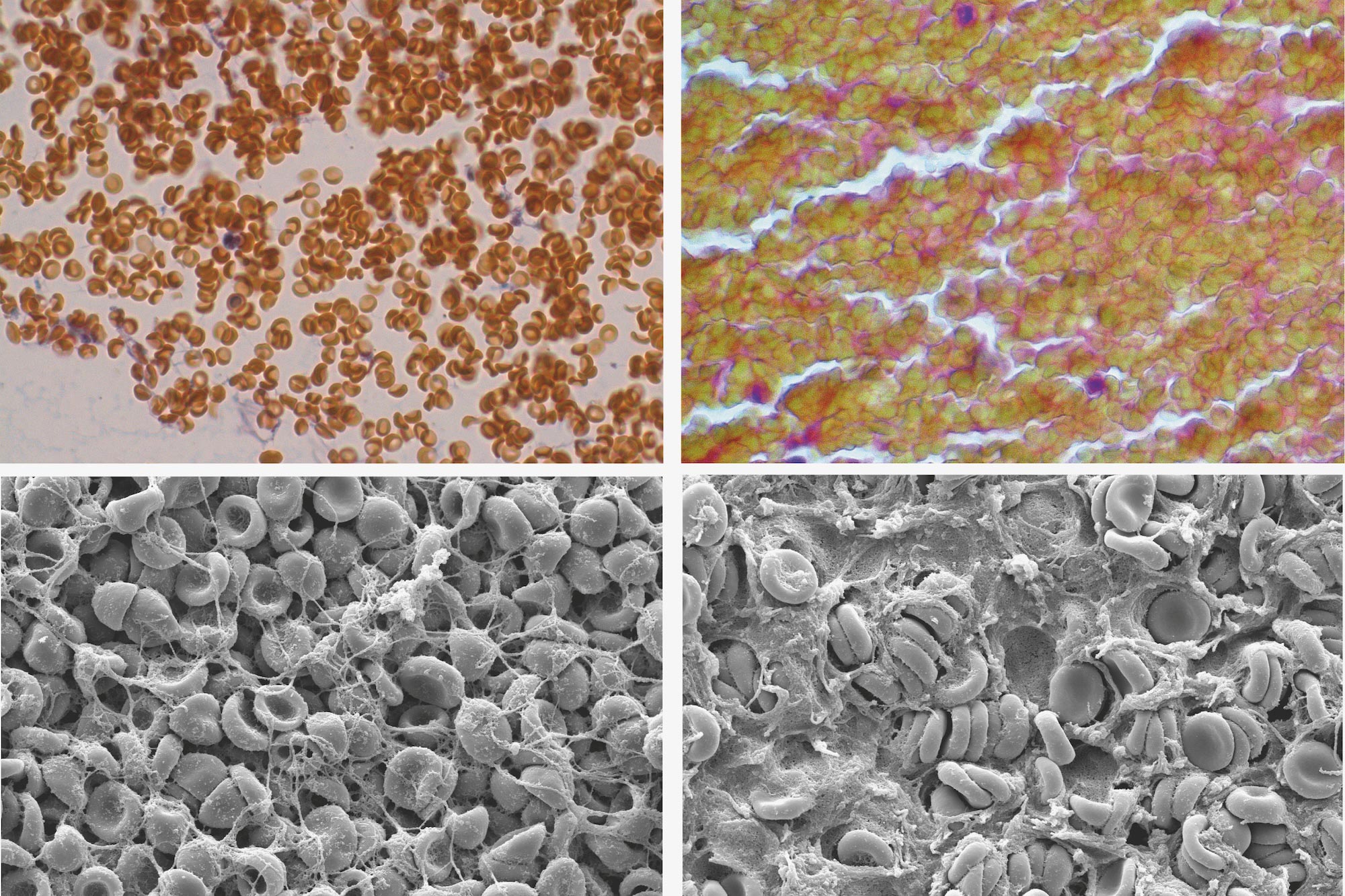
在这幅延时摄影图中,血凝块(白色部分)收缩,尽管它被设计成不含血小板。图片来源:Rustem Litvinov
当韦塞尔和利维诺夫进行一项他们预计会失败的测试时,这一假设开始被推翻。他们制造了不含血小板的血凝块。“我们原本以为什么也不会发生,”韦塞尔说。“结果,血凝块缩小了20%以上。”
为了再次验证结果,研究小组用经过化学处理以阻断血小板活性的普通血液重复了实验。血凝块仍然收缩。“那时我们意识到,红细胞的作用肯定不仅仅是占据空间,”利特维诺夫说。
为了弄清楚红细胞如何驱动这种意外行为,研究小组向机械工程师出身的普罗希特 (Purohit) 求助。
作为血凝块和凝胶等软材料方面的专家,普罗希特开发了一个数学模型,表明红细胞紧密结合主要是由于“渗透压降低”造成的。
在这些微观特写照片中,红细胞样本从左向右聚集,尽管缺乏长期以来被认为是凝血关键的血小板,但红细胞仍然变得更加致密。图片来源:Rustem Litvinov
这一过程也解释了胶体中的颗粒(油漆、牛奶或泥水等混合物)如何在周围条件发生变化时聚集并形成团簇。
“本质上,周围液体中的蛋白质会造成压力不平衡,从而将红细胞推到一起,”普罗希特说。“这种吸引力使它们更加紧密地聚集在一起,即使没有血小板,也能帮助血凝块收缩。”
当血液开始凝结时,一种名为纤维蛋白的网状蛋白质会形成网状结构,将红细胞困住并将它们拉近。“这种挤压为渗透压耗竭力的产生奠定了基础,”普罗希特说。
一旦红细胞被紧紧地挤在纤维蛋白网内,周围液体中的蛋白质就会从细胞间的狭窄空间中被挤出。这就造成了一种不平衡:细胞外的蛋白质浓度高于细胞间的蛋白质浓度,从而导致“渗透压”差异。
这种压力差就像来自外部的挤压,将红细胞推得更紧密。“这种吸引力使细胞聚集,并将机械力传递到周围的纤维蛋白网络,”普罗希特补充道。“即使没有血小板的作用,血凝块也会变得更坚固、更致密。”
先前的研究提出了另一种可能的解释:桥接,即红细胞表面小分子之间的吸引力导致它们粘附。
“我们的模型表明桥接效应是真实存在的,”普罗希特说,“但比渗透压降低的效应要小得多。”
为了测试该模型,第一作者 Alina Peshkova(现为 PSOM 药理学博士后研究员)对改良血凝块进行了一系列实验。
在没有引起桥接效应的分子的情况下,血凝块仍然会收缩,但在旨在防止渗透压耗尽的环境中,几乎不会发生收缩。
“我们通过实验证实了模型的预测,”Peshkova说。“这是理论与实践相辅相成的典范。”
更好地了解红细胞在血凝块形成和成熟过程中所起的作用,可能有助于开发出治疗血小板减少症等疾病的新方法,因为血小板计数低会导致无法控制的出血。
这一发现还可以揭示血凝块如何破碎成碎片,并在血液中流动并造成阻塞(即栓塞),从而引发中风。
Purohit 表示:“最终,我们的模型将有助于理解、预防和治疗与血液凝结相关的疾病。”
编译自/scitechdaily